سبد خرید شما خالی است.
سلول گالوانی

یک سلول گالوانی یا ولتایی (ولتاییک)، نوعی از سلولهای الکتروشیمیایی به شمار میآید که به منظور تامین جریان الکتریکی از آن استفاده میشود. این تامین جریان از طریق انتقال الکترونها به کمک واکنشهای اکسایش و کاهش (ردوکس) روی میدهد. یک سلول گالوانی نمونهای از ایده کنترل و بکارگیری انرژی به کمک واکنشهایی ساده بین عناصر مشخص است.
سلول گالوانیک ایده ای مثال زدنی است که نشان می دهد چگونه می توان انرژی را با استفاده از واکنش های ساده بین چند عنصر مشخص تولید کرد و مورد استفاده قرار داد. مطالعه نحوه چگونگی راه اندازی و کاربرد سلول گالوانی برای به دست آوردن انرژی شگفت آور است و ما در درس شیمی پایه دوازدهم با آن آشنا شده ایم.
در واقع سلول گالوانی به عنوان دستگاهی عمل می کند که همزمان واکنش های اکسیداسیون و احیا در آن اتفاق می افتد. این واکنش ها برای تبدیل انرژی شیمیایی به انرژی الکتریکی استفاده می شوند که می تواند برای اهداف تجاری بکار رود . در ادامه در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می شود.
انواع سلول گالوانی
سلول های گالوانی به دو دسته نوع اول و نوع دوم تقسیم می شوند. سلول های نوع اول غیر قابل شارژ هستند یعنی با تمام شدن واکنش دهنده ها غیرفعال می شوند. سلول های سوختی و باتری های خشک از این دسته هستند.
سلول های گالوانی نوع دوم را می توان شارژ کرد و بارها مورد استفاده قرار داد. باتری خودرو و باتری های قابل شارژ تلفن همراه ، تلفن بی سیم و لپ تاپ از این دسته هستند.
اجزای تشکیل سلول گالوانی
- آند: اکسایش در این الکترود رخ می دهد.
- کاتد: کاهش در این الکترود انجام می شود.
- پل نمکی: شامل نمک هایی است که برای تکمیل مدار و خنثی سازی الکترولیت ها مورد نیاز است.
- نیم سلول ها: واکنش های اکسایش و کاهش را به دو بخش مجزا تقسیم می کنند.
- مدار خارجی: جریان الکترون ها را بین الکترودها برقرار می کند.
- بار : بخشی از مدار است که از الکترون برای تولید جریان استفاده می کند تا عملکرد خود را انجام دهد.
نحوه کار سلول گالوانیک
در یک سلول گالوانیک ، هنگامی که یک الکترود در معرض الکترولیت قرار می گیرد ، اتم های الکترود فلزی تمایل به تولید یون در محلول الکترولیت دارد بنابراین الکترود فلزی دارای بار منفی خواهد بود. در عین حال یونهای فلزی موجود در محلول الکترولیت نیز تمایل دارند روی یک الکترود فلزی رسوب کنند. بنابراین الکترود دارای بار مثبت خواهد شد.
در شرایط تعادل ، تفکیک بار مشاهده می شود و بسته به تمایل فلزات بکار رفته ، الکترود می تواند بار مثبت یا منفی داشته باشد. از این رو ، یک اختلاف پتانسیل بین الکترود و الکترولیت ایجاد می شود. این اختلاف پتانسیل به عنوان پتانسیل الکترود شناخته می شود.
از بین دو الکترود ، الکترودی که اکسیداسیون در آن اتفاق می افتد آند نامیده می شود در حالی که الکترودی که در آن کاهش رخ می دهد ، کاتد نامیده می شود. آند نسبت به محلول دارای پتانسیل منفی است در حالی که کاتد نسبت به محلول دارای پتانسیل مثبت است. بنابراین بین دو الکترود سلول گالوانیک اختلاف پتانسیل ایجاد می شود. این اختلاف پتانسیل به عنوان پتانسیل سلول شناخته می شود.
وقتی هیچ جریانی از سلول گالوانیک گرفته نشود ، پتانسیل سلول به عنوان نیروی الکتروموتور سلول گالوانیک شناخته می شود. وقتی کلید روشن شود به دلیل اختلاف پتانسیل ، الکترون ها از الکترود منفی به سمت الکترود مثبت جریان می یابند.
تفاوت سلول گالوانی و الکترولیتی
سلول گالوانی در واقع یک سلولی الکتروشیمیایی است که در آن واکنش های اکسایش و کاهش به طور خود به خودی رخ داده و جریانی پیوسته از الکترون ها تولید می شود. ولی این واکنش ها در یک سلول الکترولیتی با استفاده از یک منبع تغذیه مجزا انجام می شود و با قطع آن جریان پیوسته الکترون نیز قطع خواهد شد.
در سلول گالوانیک کاتد، الکترود مثبت و آند، الکترود منفی است ولی در سلول الکترولیتی آند الکترود مثبت و کاتد، الکترود منفی است.
از دیگر تفاوت های این دو سلول این است که در سلول گالوانی نیم واکنش ها در محفظه های مجزا انجام شده و از طریق پل نمکی به یکدیگر متصل می شوند اما در سلول الکترولیتی هر دو الکترود در یک محفظه و در داخل محلول یا الکترولیت مذاب قرار دارند.
علاوه بر این سلول ولتایی بیشتر در باتری ها مورد استفاده قرار می گیرد در حالیکه سلول الکترولیتی برای خالص سازی مس و آبکاری کاربرد دارد.
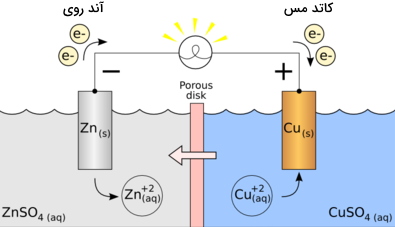
سلول گالوانی مس و روی
در این سلول الکترودهای روی و مس مورد استفاده قرار می گیرند که در آن فلزروی، دو الکترون از دست داده و فلز مس آنها را دریافت خواهد کرد. این دو فلز در دو محفظه جداگانه قرار گرفته و توسط یک سیم ، جریان الکتریکی حاصل از حرکت الکترون ها بوجود خواهد آمد. سلول گالوانی مس و نقره نیز به همین ترتیب ساخته می شود.
تبادل و انتقال یون ها بین این دو ظرف نیز به کمک یک پل نمکی یا دیواره متخلخل سلول گالوانی صورت می گیرد. در حقیقت نقش دیواره متخلخل در سلول گالوانی کمک به کامل شدن مدار الکتریکی و جلوگیری از اختلاط دو محلول است. علاوه بر این پل نمکی از NaCl یا KBr و نمک هایی از این قبیل تشکیل شده است و از تجمع بیش از حد یونهای مثبت و منفی در محلول الکترولیت جلوگیری می کند.
در صورت عدم استفاده از پل نمکی واکنشهای ردوکس انجام می شوند اما این اتفاق با سرعت بیشتری رخ داده و نمی توان محلول ها را در طول واکنش خنثی نگه داشت.